醫(yī)藥網(wǎng)8月28日訊 《中華人民共和國(guó)藥品管理法》于35年前(1984.9.20)首次制定����、18年前(2001.2.28)首次修訂��、后經(jīng)6年前(2013.12.28)和4年前(2015.4.24)的兩次修正�����,終于2019年8月26日經(jīng)十三屆全國(guó)人大常委會(huì)第十二次會(huì)議表決通過(guò)�,新版《藥品管理法》共12章�����、155條���、20666字。
其中“第二章 藥品研制和注冊(cè)”用了14條(即“第十六∽二十九條”�����,占全文155條的9%)、1940字(占全文的9.4%)的篇幅專(zhuān)門(mén)對(duì)總則“第五條 國(guó)家鼓勵(lì)研究和創(chuàng)制新藥”進(jìn)行了詳細(xì)論述�,可見(jiàn)新版《藥品管理法》對(duì)鼓勵(lì)創(chuàng)新的力度之大。
實(shí)際上早在2015年出臺(tái)的國(guó)辦44號(hào)文就開(kāi)啟了我國(guó)鼓勵(lì)創(chuàng)新的大幕����、尤其2017年出臺(tái)的兩辦文件(42號(hào)文)使藥物創(chuàng)新達(dá)到了高潮,本法也是將2015年以來(lái)發(fā)布的相關(guān)系列文件及成熟的成果上升到法律的高度����,即鼓勵(lì)本土創(chuàng)新,又要把國(guó)外的創(chuàng)新成果快速引進(jìn)為患者所用���。
現(xiàn)將《藥品管理法》鼓勵(lì)創(chuàng)新的具體條款分述如下:
一����、以臨床價(jià)值為導(dǎo)向
第十六條 國(guó)家支持以臨床價(jià)值為導(dǎo)向��、對(duì)人的疾病具有明確或者特殊療效的藥物創(chuàng)新��,鼓勵(lì)具有新的治療機(jī)理�、治療嚴(yán)重危及生命的疾病或者罕見(jiàn)病、對(duì)人體具有多靶向系統(tǒng)性調(diào)節(jié)干預(yù)功能等的新藥研制��,推動(dòng)藥品技術(shù)進(jìn)步���。
如2019版國(guó)家醫(yī)保目錄將衛(wèi)健委發(fā)布的20個(gè)重點(diǎn)監(jiān)控品種(圖1)悉數(shù)踢出����,將“非治療性藥物”占用的醫(yī)保基金讓位于具有臨床價(jià)值的藥品����,大幅提高醫(yī)保基金的使用效率�����,真正實(shí)現(xiàn)騰籠換鳥(niǎo)����,造福患者���。

二��、創(chuàng)新審評(píng)機(jī)制
第二十七條 國(guó)務(wù)院藥品監(jiān)督管理部門(mén)應(yīng)當(dāng)完善藥品審評(píng)審批工作制度,加強(qiáng)能力建設(shè)�����,建立健全溝通交流、專(zhuān)家咨詢(xún)等機(jī)制��,優(yōu)化審評(píng)審批流程�,提高審評(píng)審批效率(圖2)。
此舉為藥物創(chuàng)新提供了堅(jiān)強(qiáng)的組織保障����。

三、臨床試驗(yàn)由批準(zhǔn)制改為默示許可制��,臨床試驗(yàn)機(jī)構(gòu)由認(rèn)證管理改為備案管理
第十九條 開(kāi)展藥物臨床試驗(yàn)�,┄┄國(guó)務(wù)院藥品監(jiān)督管理部門(mén)應(yīng)當(dāng)自受理臨床試驗(yàn)申請(qǐng)之日起六十個(gè)工作日內(nèi)決定是否同意并通知臨床試驗(yàn)申辦者,逾期未通知的���,視為同意��。┄┄藥物臨床試驗(yàn)機(jī)構(gòu)實(shí)行備案管理����。
此舉可大幅提高臨床試驗(yàn)的審批效率(圖3)��。

四����、建立關(guān)聯(lián)審評(píng)審批
第二十五條 ┄┄國(guó)務(wù)院藥品監(jiān)督管理部門(mén)在審批藥品時(shí)��,對(duì)化學(xué)原料藥一并審評(píng)審批��,對(duì)相關(guān)輔料�����、直接接觸藥品的包裝材料和容器一并審評(píng)�,對(duì)藥品的質(zhì)量標(biāo)準(zhǔn)�����、生產(chǎn)工藝���、標(biāo)簽和說(shuō)明書(shū)一并核準(zhǔn)�。
改革前���,特別注重對(duì)藥包材本身質(zhì)量的評(píng)價(jià)�����,單獨(dú)審評(píng)審批���,關(guān)聯(lián)度差,導(dǎo)致每個(gè)部分(原料��、輔料�、包材)過(guò)硬,但是組合后可能不匹配����。而改為關(guān)聯(lián)審評(píng)可真正做到以制劑質(zhì)量為中心,減少審批項(xiàng)目突出制劑持有人供應(yīng)商和物料管理的責(zé)任�,如果發(fā)生問(wèn)題,會(huì)追責(zé)到個(gè)人�。
五、實(shí)行優(yōu)先審評(píng)審批
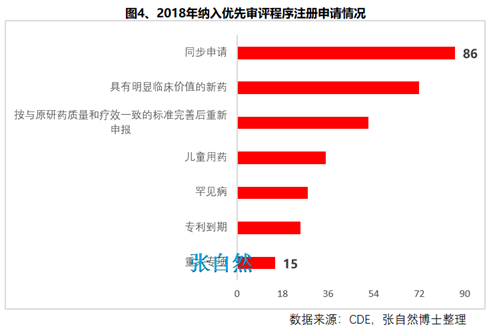
第九十六條 國(guó)家鼓勵(lì)短缺藥品的研制和生產(chǎn)�,對(duì)臨床急需的短缺藥品、防治重大傳染病和罕見(jiàn)病等疾病的新藥予以?xún)?yōu)先審評(píng)審批�。
對(duì)上述急需藥品開(kāi)辟綠色審批審評(píng)通道,大幅提高了藥物可及性(圖4)�����。
六���、建立了附條件審批制度
第二十六條 對(duì)治療嚴(yán)重危及生命且尚無(wú)有效治療手段的疾病以及公共衛(wèi)生方面急需的藥品����,藥物臨床試驗(yàn)已有數(shù)據(jù)顯示療效并能預(yù)測(cè)其臨床價(jià)值的,可以附條件批準(zhǔn)�����,并在藥品注冊(cè)證書(shū)中載明相關(guān)事項(xiàng)�����。
此舉可縮短臨床試驗(yàn)的研制時(shí)間���,使那些急需治療的患者能第一時(shí)間用上新藥���。
七、建立藥品上市許可持有人制度
此外��,為從制度設(shè)計(jì)上鼓勵(lì)創(chuàng)新�����,本法還專(zhuān)門(mén)引入了藥品上市許可持有人制度并成為本次修法的主線�����,還為此單列一章“第三章 藥品上市許可持有人”,用了11條(即“第三十∽四十條”��,占全文155條的7.1%)�����、1271字(占全文的6.2%)的篇幅專(zhuān)門(mén)對(duì)總則“第六條 國(guó)家對(duì)藥品管理實(shí)行藥品上市許可持有人制度”進(jìn)行了詳細(xì)論述�。從此�����,除生產(chǎn)企業(yè)外����,有能力創(chuàng)新出新藥品的科研機(jī)構(gòu),也將獲得產(chǎn)品上市后的巨大收益���。
此前���,國(guó)務(wù)院已批準(zhǔn)了北京等10個(gè)省市開(kāi)展MAH試點(diǎn),并已取得了積極成效(圖5)�,對(duì)加強(qiáng)藥品全生命周期的管理,鼓勵(lì)創(chuàng)新�、減少低水平重復(fù)�、優(yōu)化資源配置發(fā)揮了積極作用�。

總之,為鼓勵(lì)創(chuàng)新���,《藥品管理法》總共用了兩章(即“第二和第三章”��,占全文12章的16.7%)�����、25條(占全文155條的16.1%)��、3211字(占全文20666字的15.5%)的超大篇幅進(jìn)行描述��,我國(guó)的藥物創(chuàng)新從此有了法律上的最強(qiáng)保障��。
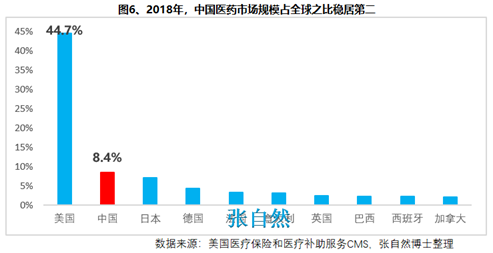
另外����,2018年10月�,通過(guò)談判將17種抗癌藥納入國(guó)家醫(yī)保,上周�����,國(guó)家醫(yī)保局再擬將128個(gè)新藥通過(guò)談判納入醫(yī)保,以及科創(chuàng)板的創(chuàng)立����,又分別從醫(yī)保支付和資本上給予藥物創(chuàng)新以前所未有的支持,我國(guó)的藥物創(chuàng)新可謂已“萬(wàn)事俱備��、不欠東風(fēng)”����,中國(guó)的制藥產(chǎn)業(yè)將為中國(guó)的患者提供更好的健康保障����,并將以更快的速度實(shí)現(xiàn)從制藥大國(guó)(圖6)向制藥強(qiáng)國(guó)(圖7)的跨越!